�A���J���̒Y�f�`����3�����O���`
�L�@���w������
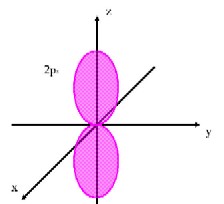
�A���J���̒Y�f�`����3�����O���`
![]()
�@�@�P�D�A���J���̒Y�f
�@�@�Ȃ����^���͐��l�ʑ̌`�����Ă���̂ł��傤���H
�@�@���^���Ɍ��炸�A�A���J�����\������Y�f���q�̌����̘r�́A�݂��ɖ�109.5���̌����p�𐬂��Ă���A���l�ʑ̂ɋ߂��`�ɂȂ��Ă��܂��B����́A�A���J���̒Y�f���q�ɂ�����S�̓d�q���A����3�����O���ƌĂ��G�l���M�[�̓������O���Ɏ��e����Ă���A�݂��ɍł������������Đ��l�ʑ̂̊e���_�Ɉʒu���悤�Ƃ��邽�߂ł��B
�@�@�ȉ��ŏڂ������Ă����܂��傤�B
![]()
�@�@�Q�D���q�ɂ���
�@�@���q�́A���S�ɂ��錴�q�j�ƁA���q�j�̎���ɂ���d�q�k�ō\������Ă��܂��B
�@�@���q�̎��ʂ̂قڑS�Ă��߂錴�q�j�́A�v���X�̓d�ׂ��������z�q�ƁA�d�ׂ������Ȃ������q����ł��Ă���A�����͊j�͂ɂ���Č��т��Ă��܂��B�������f�̌��q�j���Ɋ܂܂��z�q�̐��͂��̌��q�ԍ��Ɠ��������ł����A�����q�ɂ��ẮA�܂܂�Ă��鐔�̈Ⴄ�A����̓��ʑ�(�A�C�\�g�[�v)�����݂��܂��B�܂��A��ʂɌ��q�ԍ����傫���Ȃ�A���q�j�Ɋ܂܂��z�q�̐���������ɏ]���āA�Ód�C�͂ɂ��v���X�̓d�ד��m�̔������傫���Ȃ��Ă���̂ŁA������ɘa���邽�߂ɒ����q�̐��������Ȃ�܂��B
�@�@�d�q�k�́A�z�q�Ɠ����傫���̃}�C�i�X�̓d�ׂ��������d�q�����݂��Ă���ꏊ�ł���A���q�j�ɋ߂��������珇�ɂj�k�A�k�k�A�l�k�A�m�k�E�E�E�Ɩ��O�����Ă��܂��B���ꂼ��̓d�q�k�ɂ́A�������琔�����Ԑ����悵�ĂQ�{���������̓d�q���ő�Ŏ��e�ł��܂��B�܂�A�j�k�ɂ͂Q�A�k�k�ɂ͂W�A�l�k�ɂ�18�E�E�E�Ƃ����悤�ɓd�q�����e�ł��܂��B
�@�@�܂��A���q�ɂ����āA�ł��O���̓d�q�k�Ɏ��e����Ă���d�q�̂��Ƃ��ŊO�k�d�q�܂��͉��d�q�ƌ����A���̉��d�q�̐��ɂ���Č��q�̐�����������x���肳��Ă��܂��B��{�I�ɂ́A���̍ŊO�k�ɓd�q�������ς��Ɏ��e����Ă���A�܂�k�ł���ꍇ�A���邢�͍ŊO�k�ɂW�̉��d�q�����e����Ă���A�܂�I�N�e�b�g�������Ă���ꍇ�ɁA���q�͈���ƂȂ�܂��B�����\��18���ɂ������K�X���f(�w���E���A�l�I���A�A���S���A�N���v�g���A�L�Z�m���A���h��)�͒P�Ƃł��̕k�܂��̓I�N�e�b�g�̂��߁A�P���q���q�Ƃ��đ��݂ł��܂��B����ȊO�̌��q�ł́A���q���m���݂��ɓd�q���o���������L�����A����������ɓd�q��^���Č݂��ɉA�z�̃C�I���ƂȂ茋������C�I�������A�S�Ă̌��q���d�q����o�����R�d�q�Ƃ��Č���������������Ȃǂɂ���āA�ŊO�k���I�N�e�b�g�ɂ��悤�Ƃ��܂��B�i�������A�ߔN�ŊO�k���I�N�e�b�g�łȂ��Ă�����ł��鉻������������������Ă���j�L�@���w�ɂ����āA��Ɉ��������͋��L�����ł��B
![]()
�@�@�R�D�d�q�O���ɂ���
�@�@���ꂼ��̓d�q�k�́A����̓d�q�O���ɂ���č\������Ă��܂��B�e�d�q�O���ɂ́A�Q�܂ł̓d�q�����e���邱�Ƃ��ł���̂ŁA�j�k�͂P�̓d�q�O������A�k�k�͂S�̓d�q�O������A�l�k�͂X�̓d�q�O������E�E�E�Ƃ����悤�ɂł��Ă��܂��B�d�q�O���ɂQ�̓d�q�����e����Ă���ꍇ�A�����̓d�q�͋t�����ɃX�s��(�n���Ō����Ǝ��]�̂���)���邱�Ƃł��݂��̃X�s���ɂ�鎥�E�𒆘a�����艻����܂��B�d�q�O���́A�ǂ̓d�q�k�ł��邩�ɊW�Ȃ��A�G�l���M�[���Ⴂ���ɂ��O�����P�A���O�����R�A���O�����T�A���O�����V�E�E�E�Ƃ����悤�ɕ��ނ���܂��B������ނ̋O���́A��������Ă��G�l���M�[���������Ȃ��Ă��܂��B
�@�@�j�k�͂��O���P�݂̂���ł��Ă���A������P���O���ƌ����܂��B�k�k�͂��O���P�Ƃ��O���R����ł��Ă���A������Q���O���A�Q���O���ƌ����܂��B�܂��A�Q���O���͂R���݂��Ă��邽�߁A���ꂼ��Q�����O���A�Q�����O���A�Q�����O���̂悤�ɕ\�����Ƃ��ł��܂����A�����͕X�I�ȕ��ނł����Ă��ꂼ��ɈႢ������킯�ł͂���܂���B�L�@���w�ɂ����Ď�Ɉ����̂͂����̋O���܂łł��B(�}�E�P)�̂悤�ɁA�P���O������тQ���O���͋��`�����Ă��܂��B�Q���O���͂��ꂼ�ꈟ��i���ꂢ�j�`�����Ă���A�R���݂��ɒ������Ă��܂��B
|
(�}�E�P�@�d�q�O��) |
||||
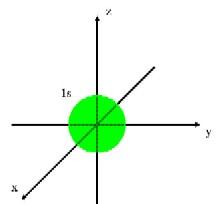 |
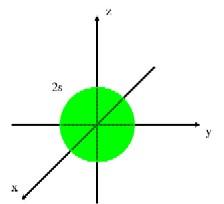 |
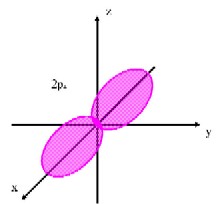 �@ �@ |
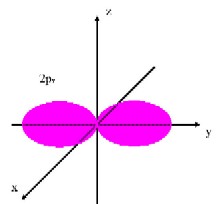 �@ �@ |
 �@ �@ |
�@�@�����̓d�q�O���́A�G�l���M�[�̒Ⴂ�����珇�ɂP���O���A�Q���O���A�Q���O���ƂȂ�܂����A�K�����������̓d�q�k�ɂ���d�q�O���̃G�l���M�[���Ⴂ�Ƃ����킯�ł͂Ȃ��A���̏��Ԃ͉��\�Ɋۈ݂͂̐����Ŏ������悤�ɁA�E�ォ�獶�߉��ɕ��Ԃ悤�ɂȂ��Ă��܂��B
| K�k | �@�@�P���@�P�� | �@ | �@ | �@ |
| L�k | �A�@�Q���@�P�� | �B�@�Q���@�R�� | �@ | �@ |
| M�k | �C�@�R���@�P�� | �D�@�R���@�R�� | �F�@�R���@�T�� | �@ |
| N�k | �E�@�S���@�P�� | �G�@�S���@�R�� | �I�@�S���@�T�� | �L�@�S���@�V�� |
�@�@�d�q�́A���G�l���M�[�̒Ⴂ�O�����珇�Ɏ��e����Ă����A�����G�l���M�[�̋O������������ꍇ�́A�܂�������e����Ă����܂��B����āA���q�ԍ��P�Ԃ̐��f�͂P���O���ɂP�̓d�q�����e����Ă���A�����(�P��)�P�̂悤�ɕ\�����܂��B���q�ԍ��U�Ԃ̒Y�f�͂P���O���ɂQ�A�Q���O���ɂQ�A�Q���O���ɂQ�̓d�q�����e����Ă���A�����(�P��)�Q(�Q��)�Q(�Q��)�Q�̂悤�ɕ\�����܂��B���̂Ƃ��Q���O���Ɏ��e����Ă���Q�̓d�q�́A�P�̋O���ɂQ�Ƃ����e����Ă���킯�ł͂Ȃ��A�Q�̂��O���ɂP�����e����Ă���A����͂R�̂��O���̂����̂ǂ̋O���ł���ʂ�����܂���B���q�ԍ���10�Ԃ܂ł̂��̑��̌��f�̓d�q�z�u�����}�Ɏ����܂��B�Ԏ��Ŏ��������͕̂k�������Ă��܂��B
|
���q�ԍ� |
���f |
K�k |
L�k |
�d�q�z�u |
|
�P |
���f |
�P |
|
(�P��)�P |
|
�Q |
�w���E�� |
�Q |
|
(�Q��)�Q |
|
�R |
���`�E�� |
�Q |
�P |
(�P��)�Q(�Q��)�P |
|
�S |
�x�����E�� |
�Q |
�Q |
(�P��)�Q(�Q��)�Q |
|
�T |
�z�E�f |
�Q |
�R |
(�P��)�Q(�Q��)�Q(�Q��)�P |
|
�U |
�Y�f |
�Q |
�S |
(�P��)�Q(�Q��)�Q(�Q��)�Q |
|
�V |
���f |
�Q |
�T |
(�P��)�Q(�Q��)�Q(�Q��)�R |
|
�W |
�_�f |
�Q |
�U |
(�P��)�Q(�Q��)�Q(�Q��)�S |
|
�X |
�t�b�f |
�Q |
�V |
(�P��)�Q(�Q��)�Q(�Q��)�T |
|
10 |
�l�I�� |
�Q |
�W |
(�P��)�Q(�Q��)�Q(�Q��)�U |
![]()
�@�@�S�D���q�̌���
�@�@���q�͂Ȃ���������̂ł��傤���H
�@�@����́A�������`�����邱�ƂŁA���݂��邽�߂ɕK�v�ȃG�l���M�[���Ⴍ�Ȃ�A�����肷�邩��ł��B
�@�@�d�q�́A�d�q�O���̒��ɑ��݂��Ă���Ə����܂������A���ۂɂ͂������̈ʒu�ɂ���킯�ł͂Ȃ��A�d�q�O���̂�����ɑ��݂��Ă���m���������Ƃ������ƂȂ̂ł��B�d�q�́A�g�����Ƃ������̂Ɋ�Â��Ĕg�̂悤�ɉ^�����Ă���A�d�q�_�ƌĂ��悤�ȏ�ԂɍL�����Ă��܂��B
�@�@����A�Q�̔g����������邱�Ƃɂ���āA���g�Ƃ����g���ł��܂��B���g�Ƃ́A���ʂ̐i�s����g�ƈ���āA�S���U�����Ȃ��߂ƁA�������U�����镠�����݂ɔz�u���Ă���g�̂��Ƃł��B���[���Œ肵������U��������ƁA���g�̈����ώ@���邱�Ƃ��ł��܂��B
�@�@�d�q�̏ꍇ���A�d�q�O���̒��Ɉ�������e����Ă���d�q�ʂ̔g�ł���ƍl����ƁA�d�q����������e����Ă���O�����m����������ƁA���g�̏ꍇ�Ɠ����悤�ɁA���̓d�q�O����荂�G�l���M�[�̋O��(���������O��)�ƁA��G�l���M�[�̋O��(�������O��)���`������܂��B���̂Ƃ��A�����̋O���ɂ��Q�܂ł̓d�q�����e����邽�߁A�Q�̓d�q�͗����Ƃ��������O���Ɏ��e����܂��B���̌��ʁA�S�̂ő��݂��邽�߂ɕK�v�ȃG�l���M�[���Ⴍ�Ȃ�A�����艻���邱�Ƃ��ł���̂ł��B(�}�E�Q��)
�@�@���f��Y�f�Ȃǂ́A�d�q�O���ɂP�������e����Ă���d�q�A�܂�s�Γd�q�������Ă��錴�q�́A���̂悤�ɂ��Č������`�����邱�Ƃň��艻���邱�Ƃ��ł��܂��B
�@�@���l�ɂ��āA�w���E�����Ȃ����������炸�A�P���q���q�Ƃ��đ��݂���̂��������ł��܂��B�w���E���́A�P���O���ɂQ�̓d�q�������Ă��܂����A���̋O�����m�����������ꍇ�A���f�Ȃǂ̏ꍇ�Ɠ��l�ɁA���������O���ƌ������O�����`������܂��B�����ŁA�����Ɏg�p���ꂽ�S�̓d�q�̂����A�Q�͌������O���Ɏ��e�����̂ł����A�ʂ̂Q�����������O���Ɏ��e����邽�߁A�S�̂Ƃ��Č������Ă����݂��邽�߂ɕK�v�ȃG�l���M�[���Ⴍ�Ȃ�܂���B�i�}�E�Q���j����āA�w���E���͌����ɂ���Ĉ��艻�ł��Ȃ��̂ŁA�P���q���q�Ƃ��đ��݂���̂ł��B
|
(�}�E�Q�@�����ɂ��G�l���M�[�̕ω�) |
|
�@ |
|
�@ |
![]()
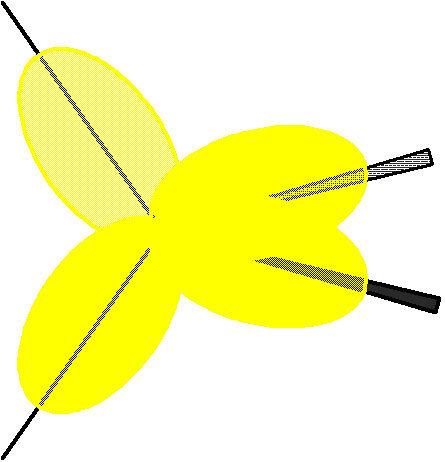
�i�}�E�R�@����3�����O���j
�@�@
�T�D�d�q�O���̍����@�`����3�����O���`
�@�@�Y�f���q�́A��Ɏ������悤�ɁA��̂Q���O���ɂQ�́A�O�̂Q���O���ɂQ�̓d�q�������Ă��܂��B�������A���̂܂܂ł͑��̌��q�ƌ�����������ꂸ�A�I�N�e�b�g�ɂȂ邱�Ƃ��ł��܂���B���ɓ�̌��q�Ƌ��L���������ꍇ�A�Q���O������g���Č������邱�ƂɂȂ�̂ŁA���̌����p�x��90���ƂȂ�A��蔽���͂����ɁA�Q���O���̂�����͋�O��(�d�q�̑S�������Ă��Ȃ��O��)�ƂȂ��Ă��܂��܂��B
�@�@�����ŁA�Y�f���q�́A����̈�̂Q���O���ƎO�̂Q���O��������(�������킹�ĐV�����O�������邱��)�����A�V���ɂ���3�����O���Ƃ����l�̃G�l���M�[�̓������O�������グ�܂��B���̂���3�����O����̌`��(�}�E�R��)�̂悤�ɂȂ��Ă��܂��B�����݂��ɃG�l���M�[�̓������O���́A������������(�}�E�R��)�Ɏ����悤�ȁA�݂��ɖ�109.5�����ꂽ���l�ʑ̌`�̍\�����Ƃ�܂��B���̐}�ɂ����āA�����O�p�`�ŕ\���ꂽ���͉�ʂ̎�O�������Ă���A�D�F�̎O�p�`�ŕ\���ꂽ���͉�ʂ̌��������������Ă��܂��B�Ȃ��A�Q���O���P�A�Q���O���R���琬���Ă��邓��3�����O���́A��������O�̂Q���O���̐�����25���A�Q���O���̐�����75�������Ă��܂��B
�@�@�������āA�G�l���M�[�̓������l�̋O������ɓ��ꂽ�Y�f���q�́A���̎l�̌��q�Ƌ��L����������A�I�N�e�b�g���������Ƃ��ł���悤�ɂȂ�܂����B�����ɗႦ�S�̐��f����������ƁA���^���b�g�S
�ƂȂ�܂��B�i�}�E�R���j


![]()
|
|
|
�@ |
|
�n�����Fpropane |
|
�@�@�Y�f�����R�̃A���J���i���^���n�Y�����f�j�ɑ�����B�v���p�����̂Ɉِ��̂͑��݂��Ȃ����A�u����Ƃ��Ă͂��ꂼ��P�ʂ̐��f����тQ�ʂ̐��f��u�������v���s����E�C�\�v���s������݂���B |