例年に比べ、大きく易化した2008年、第1問は問8までの問題は満点狙いで行きたいですね。
さて、フロギストン説、ドルトンの原子説と倍数比例の法則ときて、
次のセクションIIIは、酸・塩基に関する問題です。
Ⅲ.
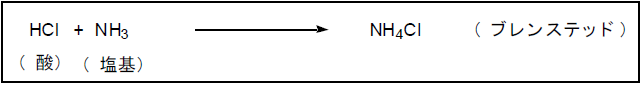
19世紀末にアレーニウスは、水に溶けて水素イオンが生じる物質を酸、水酸化物イオンが生じる物質を塩基と初めて定義した。一方、ブレンステッドは酸・
塩基を水素イオンの授受というより広い視点からとらえ、酸とは水素イオンを与える物質であり、塩基とは水素イオンを受け取る物質であるとした
(1923)。この定義に従う酸・塩基をブレンステッド酸・ブレンステッド塩基と呼ぶ。この概念を適用すると、有機化合物の反応も酸・塩基の反応と見なせ
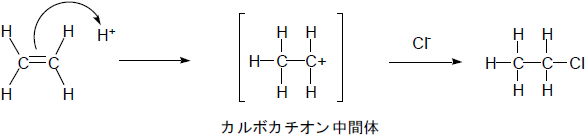
る場合がある。エチレンと塩化水素の反応を例に詳しく見てみよう。
|
|
|
エチレンの二重結合は 【 あ 】
個の電子から形成されているので、単結合にくらべて電子が豊富であり、電子が不足している物質と反応しやすい。塩化水素との反応は、二重結合の電子の一部
(π電子と呼ばれる)が水素イオンを攻撃し、カルボカチオンと呼ばれる陽イオン中間体を経由して進行する。すなわち、この場合はエチレンが塩基ということ
になる。
さらに研究が進むにつれ、例えば硫酸や塩酸が促進する触媒反応において、明らかにブレンステッド酸ではないBF3 やAlCl3
のような化合物も、全く同じ効果を示す場合があることがわかり、これらも酸として取り扱う必要性が生じてきた。そこで、ルイスは酸・塩基の概念をさらに一
般化し、酸は電子対を受け入れることのできる物質であり、塩基は電子対を供与できる物質であると定義した。
ルイスの定義により、特に酸の概念は大きく拡張された。当然、水素イオンは多くの酸の一つにすぎないし、この定義では金属元素の陽イオンも酸になる。例
えば、酸化銀の沈殿に過剰のアンモニア水を加えたときに起こる反応も酸・塩基反応である。
|
|

|
アンモニアの窒素は1組の非共有電子対を持ち、これを銀イオンが受け入れて 【 A
】 結合が形成され、ジアンミン銀(I)イオンが生じて溶ける。
ルイスの酸の概念はブレンステッドのそれを包含しているが、特にブレンステッドの定義の範囲を超えたものをルイス酸と呼ぶことが多い。前述したBF3
やAlCl3 は典型的なルイス酸である。
陽イオンを生じることがなく電気的にみて中性なこれらの化合物が、酸であることに違和感を覚えるかもしれない。そこでBF3
を例にルイス酸について考えてみよう。ホウ素原子の最外電子殻には 【 い
】 個の電子があり、これをフッ素原子と共有することにより分子が形成される。ホウ素原子の最外電子殻は、最大で 【 う 】
個の電子を収容することができるため、更に 【 え 】組
の電子対を受け入れられる。その結果、ホウ素原子の電子配置は、希ガスの 【 B
】と同じになる。すなわち、BF3 は【 え 】組の電子対を受け入れることで、より安定な状態になると考えら
れる。
実はルイスの酸・塩基の概念はブレンステッドのそれと同じ1923 年に提唱されたが、その意味するところの重要性が認識されたのは1930
年代に入ってからであった。ここでは、酸・塩基に関わるいくつかの問題を考えてみよう。 |
問8 文中の【 A 】と【 B 】に
は適当な語句(ただし【 B 】は元素名)
を、【 あ 】 〜【 え 】 には適
当な数値を入れなさい。 |
|
問8 ここは簡単でしょう。
エチレンの二重結合は4個の電子から形
成。
(σ結合を形成する電子が2個、π結合を形成する電子が2個)
電子対を貸してあげるよ〜といえば、配位結合。
(広い意味で、共有結合でも可だと思われるが、ここは配位結合と書いた方がベター)
ホウ素原子の最外電子殻(L殻)には3個の
電子。
(2s軌道に2個、2p軌道に1個)
L殻には、最大で8個の電子が収容可能。
(2p軌道にあと5個入る)
【 え 】は問題文がちょっと悪い…。主語が抜けてて分かりにくい。
ホウ素の最外電子殻は最大8個の電子を収容することができるため、
<BF3 は>更に【 え 】組の電子対を受け入れられる。
と補って考えて、答えは1組
まあ、後でもう一度出てくるから分かるとは思いますが。
5個電子が増えれば、ぼくの(お)ふね〜〔B→C→N→O→F→Ne(ネオン)〕
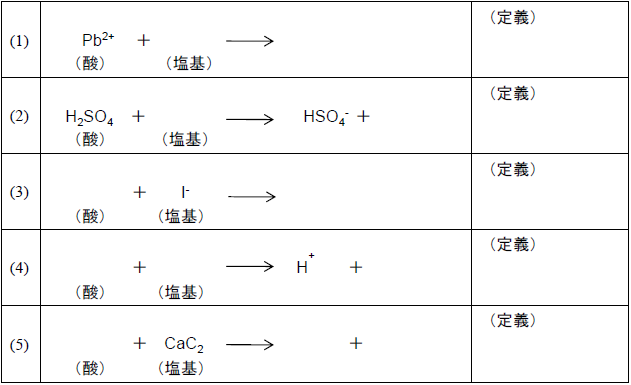
問9 以下の1〜5の現象は全て酸・塩基の概念で取り扱うことができる。例にならって解答欄の
反応式を完成しなさい。出発物質(左辺)はどれが酸または塩基として働くかを考え、(酸)または
(塩基)という文字の上に記すこと。また、ブレンステッドの定義だけで説明できるものを(ブレンス
テッド)、ルイスの定義によりはじめて説明できるものを(ルイス)と記入しなさい。 |
例
気相中でアンモニアと塩化水素を反応させる。 |
|
|
(1) 鉛(II)イオンを含む水溶液にクロム酸カリウムを溶かすと、黄色の沈殿が生じる。
(2) 氷酢酸中に濃硫酸を添加する。
(3) 水にはほとんど溶解しないヨウ素が、ヨウ化カリウムの水溶液には良く溶ける。
(4) 二酸化炭素を水に吹き込む。
(5) 炭化カルシウムに水を加える。 |
解答欄↓ |
|
|
|
問9 解答欄は上のように、穴埋め形式となっています。
(1)『鉛(II)イオンを含む水溶液にクロム酸カリウムを溶かすと、黄色の沈殿が生じる』
クロム酸イオンって知ってる〜? という問題。
クロム酸イオンが CrO42- だと知っていれば余裕。知らないと書けない。
あとは、 Pb2+ は酸だと、なぜか過剰な誘導がしてあるので、
|
Pb2+
|
+
|
CrO42-
|
―→
|
PbCrO4 (黄色沈殿)
|
|
(酸)
|
|
(塩基)
|
|
|
と書くだけ。
カリウムイオンは反応には関わってないので書かない!
(定義)は、 H+ なんて影も形も見えないので、ルイスの
定義
要するに、この問題では、
H+ (水
素イオン、プロトン)を授受し合うのが、「ブレンステッドの定義」における酸・塩基。
それ以外はぜんぶ「ルイスの
定義」における酸・塩基というわけだ。
さて、ルイスの定義においては、電子対を
供与(電子対あげるよ〜)する方が塩基。
つまりは、マイナスの方が塩基ということ。
そして、プラスの方が酸ということになる。
そーゆーわけで、 Pb2+ は酸で、CrO42-は塩基というわけだ。
ところで、この
『鉛(II)イオンを含む水溶液にクロム酸カリウムを溶かすと、黄色の沈殿が生じる』
という反応は、
無機化学では有名な反応で、鉛(II)イオンの検出法としても用いられますね。
(2)『氷酢酸中に濃硫酸を添加する』
まず、氷酢酸というのは、純度が高い酢酸(市販されているものは、純度99%ぐらい)のことで、
融点(凝固点)が約17℃と低いため、冬場には凝固してしまうため、この名前がついています。
余談ですが、氷砂糖は、純度の高いショ糖の大きい結晶のことですが、
こちらは、外見が氷のように見えるということでこの名前がついています。
砂糖(ショ糖)は、夏でも固体ですからね(笑)
さてさて、弱酸である酢酸は、濃度が高くなると、ほとんど電離しなくなります。
なぜか? というと、濃度が高いということは、水(H2O)が少ないということで、
以下の電離平衡が ← へ進んでしまうから、ですね。
CH3COOH + H2O 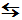 CH3COO-
+ H3O+
CH3COO-
+ H3O+
氷酢酸は、前述したとおり、純度が高い酢酸、つまり、めっちゃ濃いーーー酢酸ですから、
酢酸分子はほとんど電離していないと考えられます。
したがって、↓の答えは△かな。
|
H2SO4
|
+
|
CH3COO-
|
―→
|
HSO4-
|
+
|
CH3COOH
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
というわけで、答えは、
|
H2SO4
|
+
|
CH3COOH
|
―→
|
HSO4-
|
+
|
CH3COOH2+
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
もちろん、↑の反応式は、実際には平衡反応です。
あんまり見かけない式ですが、要するに、
水溶液中ならば、
H2SO4 + H2O 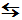 HSO4-
+ H3O+
HSO4-
+ H3O+
となるけれども、
溶媒が酢酸であったがために、
H2O が CH3COOH に置き換わって、
H2SO4 + CH3COOH 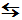 HSO4-
+ CH3COOH2+
HSO4-
+ CH3COOH2+
となった、ということです。
(定義)は、 もちろんブレンステッド。
H + をやり取りしていますからね!
(3) 『水にはほとんど溶解しないヨウ素が、ヨウ化カリウムの水溶液には良く溶ける』
反応式を見たことがないと、訳が分からないと思われます。
とりあえず、空欄となっている酸の部分には、I2 を入れるしかな
い。
すると…、もう、訳も分からず、I3- と
書くしかないではないか!
というわけで、
|
I2
|
+
|
I -
|
―→
|
I3- (褐
色)
|
|
(酸)
|
|
(塩基)
|
|
|
小学校の実験でおなじみのヨウ素液(ヨウ素ヨウ化カリウム溶液)の褐色色の正体
は、
実はこのI3- (三ヨウ化物イオ
ン)の色なんですね。
そして、カリウムイオンは反応には関わってないので書かない!
カリウムイオンはまた用無し…。
(定義)は、 H+ なんて影も形も見えないので、ルイスの
定義
(4) 『二酸化炭素を水に吹き込む』
これはおなじみの反応。文句なしに、下の反応式はかけるでしょう。
|
CO2
|
+
|
H2O
|
―→
|
H+
|
+
|
HCO3-
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
まさか、↓のように書く人はいないでしょう。
|
CO2
|
+
|
H2O
|
―→
|
2H+
|
+
|
CO32-
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
炭酸イオンはめちゃ不安定ですからね。
というか、H+ の欄に 2 を書き加えてるし(爆)!
さて、難しいのは(定義)ですね。
一見、H+ が反応式中にあるので、ブレンステッド! と答えたくもなりますが、よく考えてみてください。
ブレンステッド酸とは、H+ を相手に与えることのできる物質、のことでしたね。
でも、CO2 は相手にH+ を与えるどころか、H
さえ持ってませんよ!
そう、よくよく見ると、H+ のやりとりはしていないのです!!
ということで、ルイス!となるわけです
が、
詳しく電子の移動図で説明すると、
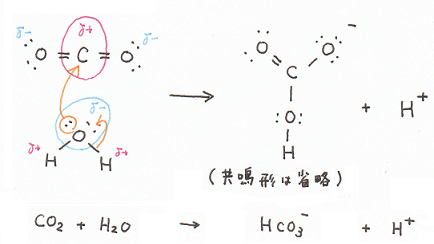
二酸化炭素の求電子的な(僅かに正に帯電した部分である)炭素に、
水の求核的な(僅かに負に帯電した部分である)酸
素がアターーック(求核攻撃)して、
オレンジ矢印のように電子対が動いて、矢印の右側のようになるわけですね。
訳が分からない人は、ココ(去年の有機の問題)を
参照。
(5) 『炭化カルシウムに水を加える』
これは有機化学では有名な反応。アセチレンの製法で出てくる。
が、反応式を見たことがない場合、ゼロから反応式を作るのはかなり厳しい。
以下、反応式を見たことがない場合を想定して、実況中継風に解説する。
ヒントとして与えられているのは、炭化カルシウム(CaC2)は
塩基としてはたらくという事実(←
解答用紙に記されている)と問題文だけ。
ということは、水を加えるんだから、H2Oは酸として働く、ってことだよなぁ。
とりあえず、ブレンステッドの定義で考えてみる。
あれ、でも、H+ は CaC2 とどう反応するんだろう?
ってゆーか、そもそも C2 って何よ?
<ここでなんとか不老不死で正体不明の C2 の正体が、C≡Cであったと気づいたとしよう>
どうやって気付けばいいのか?
C2 2- を達成するためには、[ :C≡C: ]2- とするしかないでしょう!
三重結合にアレルギーのある人は早く治してください(爆)
そして、うーーん、H+ は Ca2+ とは反応しないだろうから、C.C.…もとい、C2 と
反応するんだろうなぁ…。
ということは、H−C≡C−H になるのかな?
たぶんそうだろう。
…ということは、
|
H2O
|
+
|
CaC2
|
―→
|
CaO
|
+
|
C2H2
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
だな!
完成! (定義)はたぶん、ブレンステッドだ!
(完)
…としたら、うーん、もしかしたら減点喰らうかもしれませんねぇ。
CaO(生石灰)は水と反応して、Ca(OH)2(消
石灰)になります。
これも踏まえて反応式は作るべきでしょうかね。
というわけで、
CaO + H2O ―→ Ca(OH)2 を加えて、
|
2H2O
|
+
|
CaC2
|
―→
|
Ca(OH)2
|
+
|
C2H2
|
|
(酸)
|
|
(塩基)
|
|
|
|
|
これが正解!
…というように、無理矢理、反応式を組み立てることもできなくもないですが、
流石に厳しいですね。
そして、この反応は、2価のアセチレンの陰イオン[C≡C]2- が水(H2O)からH+ を2
つ受け取って
アセチレン(C2H2)が発生するので、ブレンステッド
の酸・塩基の定義で説明できる、というわけです。
以上のように、問9の問題は、
答えを知っていると、考える間もなく、瞬時に求まってしまう問題
であり、結局は履修未履修の差を出してしまう問題であった。
とはいえ、学校で習う「おなじみの反応」が、
ルイスの定義による酸・塩基の考え方を用いることによって説明できる
という「驚き」が、この問題にはある。
ところが、私立の学校の中には、酸・塩基の単元を扱う際、ルイスの定義にまで踏み込んで教える学校もあり、
二次進出者の多くが私立出身である現状を踏まえると、あまり真新しさはなかったかもしれない。
酸・塩基に関するルイスの定義(ルイス酸、ルイス塩基)は、有機化学でよく目にする。
というか、去年の有機の問題に、「ルイス」の名前こそ出ないものの、しっかり出題され
てたような…?
過去問はやるべきですね〜〜。



