|
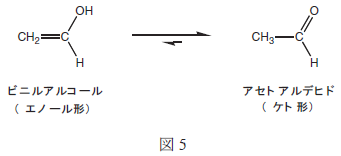
このように酸あるいは塩基の作用によって進行する反応は多い。次にケトンやアルデヒドといったカルボニル化合物の反応を考えよう。ケトンやアルデヒドには,ケト形とエノール形と呼ばれる異性体が存在する(注3)。聞き慣れないかもしれないが,高校の教科書にも例が載っている。アセチレンに水が付加するとアセトアルデヒドが生成するが,このとき最初に生成するのはビニルアルコールである。アセトアルデヒドもビニルアルコールも同じ分子式C2H4Oで表され異性体の関係にある。ここでアセトアルデヒドはケト形であり,ビニルアルコールはエノール形であるとされる(図5)。 (注3) アルケン(alkene)とアルコール(alcohol)からなるのでエノール(enol)と呼ぶ。また,ケト−エノールのように,互いに異性化する速度が速く,平衡状態にある異性体のことを互変異性体と呼ぶ。 |
|
|
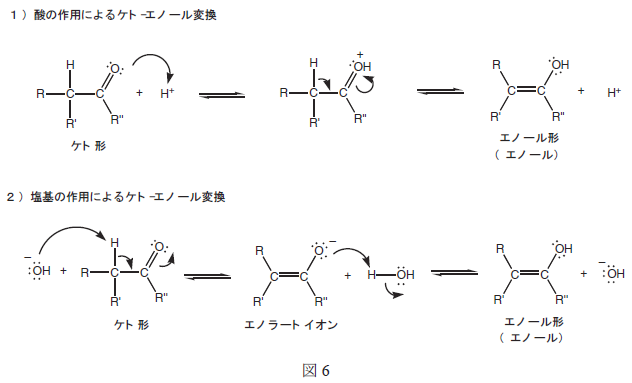
| 両者は酸あるいは塩基触媒によって相互に変換される(図6)。通常,エノール形はケト形に比べずっと不安定なので,エノール形は極微量しか存在しないが,溶液中で両者は平衡にある(反応は可逆的である)。このケト―エノール変換は,酸あるいは塩基の作用によって,カルボニル基の隣の炭素(α位と呼ぶ)と酸素の間で水素が移動するとともに,二重結合の位置が移動している過程と考えることができる。なお,エノール形の化学種は単にエノールとも呼ばれる。 |
|
|
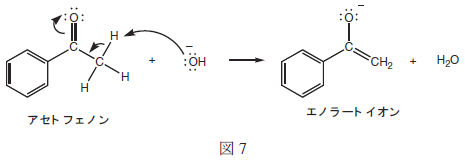
| 図6に示したように,塩基触媒による変換では,エノラートイオンと呼ばれる化学種が生成する。このエノラートイオンが関与する反応も多くあり,一例はヨードホルム反応である。アセトフェノン(メチルフェニルケトン)の反応を考えてみよう。この反応では最初に,アセトフェノンと水酸化物イオンが反応してエノラートイオンが生成する(図7:カチオンは省略してある)。 |
|
|
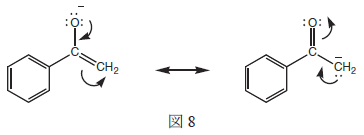
| ただし,エノラートイオンは正確には図7に示した構造ではなく,図8 の右に示す炭素アニオンをもつ構造と混成したものである(注4)。すなわち,エノラートイオンでは酸素原子もα位の炭素原子も求核性が高い。ここでは便宜上,炭素に負電荷をもつ構造のみを描いて話を進める。 (注4)図8の右と左の構造は,それぞれ容易に電子式を書くことができ,原子の位置は全く変えずに電子対だけを動かすことで相互に変換できる。このようなとき,それぞれの構造を共鳴構造といい,真の分子の構造はこれらが電子的に混成したものである。詳細は解説に記載する。 |
|
|
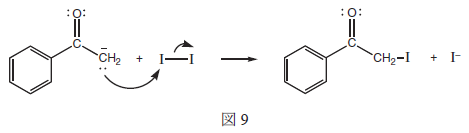
| エノラートイオンが反応するとき,酸素原子で反応するか炭素原子で反応するかは,反応する化合物の性質や反応条件によるが,ヨウ素との反応では図9に示すようにα位の炭素がヨウ素化される。この反応はα位の水素が全てヨウ素に置き換わるまで進行する。 |
|
|
| 問4 この反応では,1段階目のヨウ素化よりも 2段階目,2段階目よりも 3段階目のヨウ素化の方が容易に進行する。これは,ヨウ素が置換することによって,エノラートイオンの生成が容易になっているからである。このことから,エノラートイオンの安定性に対して,水素とヨウ素の違いが及ぼす影響を,電気陰性度(注2)をもとに 50字以内で述べなさい。 (注2)電気陰性度は原子が共有結合を形成したとき,それぞれの原子が電子を引きつける強さを数値化したもので,数値が大きいほど引きつける強さは大きい。例えば水素=2.1,炭素=2.5,酸素=3.5,塩素=3.0,臭素=2.8,ヨウ素=2.6 などである。 |
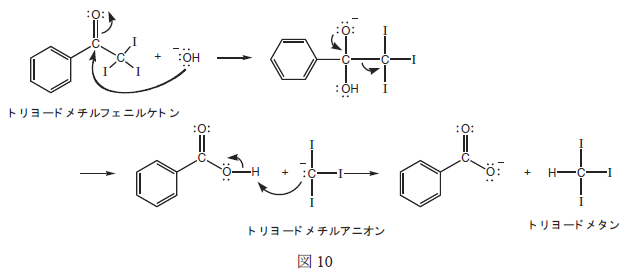
| トリヨードメチルフェニルケトンと水酸化物イオンとの反応では,炭素−酸素結合の生成に次いで炭素−炭素結合の開裂が起こり,安息香酸とトリヨードメチルアニオンとなる。最終的にプロトンが移動してトリヨードメタン(ヨードホルム)が生成する(図10)。 |
|
|
| このようにケトンやアルデヒドのカルボニル基の炭素原子は,アニオンのような求核性を有 する試薬(求核剤)の攻撃を受ける。逆に言えば求電子剤として働いているといえる。 |