途中から「化学平衡」の理解が必要になりますね。
問4 水性ガスシフト反応は工業的に重要な反応で CO の除去および
H2/CO
比の調整法として
用いられている。以下の各設問に答えなさい。ただし,ΔHf°
およびΔSr° の温度依存性は
無視できるとする。
CO(g) +
H2O(g) 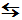 CO2(g) +
H2(g) (8) CO2(g) +
H2(g) (8)
(1)
表2のデータを用いてこの反応の298 K
における標準反応エンタルピー,標準反応エントロピ
ーおよび標準反応ギブズエネルギーを求めなさい。
(2)
密閉された容器の中で等モルのCO(g)およびH2O(g)を反応させる。反応したCO(またはH2O)
の割合(反応率)を
a とするとき,平衡定数と a の関係を示しなさい。
(3) 平衡状態における反応率が
0.9 となるときの温度を求めなさい。
(log 3 =
0.4771、気体定数 R =
8.314 J mol-1 K-1
) |
| |
問4(1) 今までの問題と同じように式を立てます。
(生成系)−(反応系)でしたね! 要は、(右辺)−(左辺)をします。
ΔHr°=
ΔHf°(CO2) + ΔHf°(H2) - {
ΔHf°(CO) + ΔHf°(H2O) }
= -393.51 + 0 -
{ -110.53 + (-241.82)
}
=
-41.16(kJ)
エントロピーも同様に、
ΔSr°=
Sm°(CO2) + Sm°(H2) - {
Sm°(CO) + Sm°(H2O) }
= 0.21374 +
0.130684 - ( 0.19767 + 0.18883 )
=
-0.042076
≒ -0.04208(kJ K-1)
もしくは、カッコよく、-4.208×102(kJ
K-1)
としてもいいですね。
ギブズエネルギーは、ΔGr =
ΔHr - TΔSr より、
ΔGr°= -41.16 -
298 × ( -0.042076 )
=
-28.621352
≒ -28.62(kJ)
(2) さあ、化学平衡ですよ!
表で整理すると、以下のようになります。
反応前のCOの物質量(モル数)をn[mol]とすると、
|
|
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
反応前 |
n |
n |
0 |
0 |
|
(反応中) |
-an |
-an |
+an |
+an |
|
反応後 |
(1-a)n |
(1-a)n |
an |
an |
平衡定数Kは、(生成系)/(反応系)、つまり(右辺)/(左辺)で表されますね!
よって、反応後の平衡定数は、
K = a2n2 /(1-a)2n2
= a2 /(1-a)2
= ( a/1-a )2
(3) a =
0.9のとき、(2)の答えに代入すると、
K = ( 0.9/1-0.9 )2 =
81 となるので、
log K =
log 81 = log 34 = 4 log
3 となります。
ここで、log 3 = 0.4771 と与えられているので、
log K =
1.9084 となります。
<ありがちな間違い その1>
(1)より、ΔGr°=
-28.62(kJ)なので、
(1)は温度を勝手に298Kと定義して求めたギブズエネルギーなので計算に用いてはいけない。
さらに、式に代入するときには、有効数字+1ケタ!
<ありがちな間違い その2>
-ΔGr°= 2.303RTlog
K 、 ΔGr = ΔHr - TΔSr より
2.303RTlog K = -(ΔHr°-
TΔSr°)
2.303RTlog K - TΔSr°= -ΔHr°
T (
2.303Rlog K - ΔSr°) = -ΔHr°
T ( ΔSr°-
2.303Rlog K ) = ΔHr°
T = ΔHr°/ ( ΔSr°-
2.303Rlog K )
ここまではあってますね。
さて、ここで、
ΔHr°= -41.16(kJ)
ΔSr°= -0.042076(kJ K-1)
R =
8.314 (J mol-1 K-1)
log K =
1.9084
を代入して……
問3でもありましたが、単位を[kJ]にそろえるために、
R = 8.314
x
10-3
( kJ mol-1 K-1
) として代入しなければなりません。
この値で代入すると、
T = -41.16 / -0.042076 - 2.303 x
8.314 x 10 -3 x
1.9084
≒
523.55
≒
523.6(K)
問5 コークスから水性ガスを製造する際の反応は次のように表される。
C(s)
+ H2O(g) 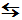 CO(g) +
H2(g)
(9) CO(g) +
H2(g)
(9)
この反応を密閉された容器の中で行うとし,初めに十分な量のC(s)と1
bar のH2O(g)のみが容器
内にあったとする。H2O(g)の反応率をa
とするときこの系の平衡定数K とa の関係を示しなさい。
また,平衡状態における反応率が0.9
以上となるためには温度を何度以上にすればよいか答えな
さい。
(log 3
= 0.4771、気体定数 R = 8.314 J mol-1
K-1
)
|
|
問5 炭素は十分にあるので、無視して考えることができるので、
反応前のH2Oの物質量(モル数)をn[mol]とすると、
|
|
H2O(g) |
CO(g) |
H2(g) |
|
反応前 |
n |
0 |
0 |
|
(反応中) |
-an |
+an |
+an |
|
反応後 |
(1-a)n |
an |
an |
よって、反応後の平衡定数は、
K = a2n2 /(1-a)n
= a2 / 1-a
あとは、問4とまったく同様に計算するだけです。
ただし、エンタルピー、エントロピーの計算においては、炭素を省略してはいけません。
炭素も反応系に入っていますからね。
a
= 0.9のとき、K = 8.1 となるので、
log K = log 8.1 = log
(81/10) = log 81 - log 10 = log 34
-1 = 4 log 3 -1 = 0.9084
数II の常用対数での必須手法ですね。
log
2 の値が与えられている場合に、log 5
の値を求めろ、という問題を見たことがあるはず。
また、エントロピー、エンタルピーは、表2の値を使い、
ΔHr°= ΔHf°(CO) +
ΔHf°(H2) - { ΔHf°(C) +
ΔHf°(H2O) }
= 131.25(kJ)
ΔSr°=
Sm°(CO) + Sm°(H2) - {
Sm°(C) + Sm°(H2O) }
=
0.133784
≒ 0.13378(kJ K-1)
-ΔGr°= 2.303RTlog K 、 ΔGr =
ΔHr - TΔSr より
2.303RTlog K =
-(ΔHr°-
TΔSr°)
2.303RTlog K - TΔSr°= -ΔHr°
T (
2.303Rlog K - ΔSr°) = -ΔHr°
T ( ΔSr°-
2.303Rlog K ) = ΔHr°
T = ΔHr°/ ( ΔSr°-
2.303Rlog K )
種々の値を代入して、
T = 131.25 / 0.13378 - 2.303 x 8.314
x 10-3 x
0.9084
≒
1127.7
≒ 1128(K)
それにしても、公式の解答では、この問4、問5と
気体定数 R を 8.3145
として計算していますが、
問題冊子に書かれていないはずの小数第4位がなぜ分かったのでしょうね。
問6 次の各反応の標準反応ギブズエネルギーが次のように与えられているとき,各金属イオン
の標準生成ギブズエネルギーを求めなさい。また,各金属の酸化されやすさの序列を示しなさ
い。ただし,H+(aq)の標準生成ギブズエネルギーは0
とする。
(ア)
Cu2+(aq) + Zn(s)
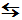 Cu(s) + Zn2+(aq)
ΔGr
° = -212.55 kJ Cu(s) + Zn2+(aq)
ΔGr
° = -212.55 kJ
(イ)
2H+(aq) + Fe(s) 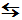 H2(g) +
Fe2+(aq)
ΔGr ° = -78.90
kJ H2(g) +
Fe2+(aq)
ΔGr ° = -78.90
kJ
(ウ)
Fe2+(aq) + Zn(s) 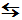 Fe(s) + Zn2+(aq) ΔGr ° =
-68.16 kJ
Fe(s) + Zn2+(aq) ΔGr ° =
-68.16 kJ
(エ)
Pb2+(aq) + Zn(s)
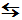 Pb(s) + Zn2+(aq)
ΔGr
° = -122.63
kJ Pb(s) + Zn2+(aq)
ΔGr
° = -122.63
kJ |
|
問6 金属の酸化されやすさなんて、イオン化列を覚えていれば楽勝さ!
ということで、序列だけは、すぐに書くことができますが、
ちゃんと計算を要求しているところがニクいですねぇ。
H+(aq)の標準生成ギブズエネルギーが基準となっているので、
まずは(イ)より、
ΔGf°(H2) + ΔGf°(Fe2+) - { 2ΔGf°(H+) + ΔGf°(Fe) } =
ΔGr°となりますが、
「標準状態における単体の標準生成ギブズエネルギーは0とする」、
および「H+(aq)の標準生成ギブズエネルギーは0 とする」とあるので、
実質、ΔGf°(Fe2+) =
ΔGr°となるので、
ΔGf°(Fe2+) =
-78.90(kJ mol-1)
となります。
同様に、(ウ)においても、
実質、ΔGf°(Zn2+)
- ΔGf°(Fe2+) =
ΔGr°となるので、
ΔGf°(Zn2+)
= -68.16 +
(-78.90)
=
-147.06 (kJ mol-1)
(ア)では、
実質、ΔGf°(Zn2+)
- ΔGf°(Cu2+) =
ΔGr°となるので、
ΔGf°(Cu2+)
= -147.06 -
(-212.55)
=
65.49(kJ mol-1)
(エ)は、
実質、ΔGf°(Zn2+)
- ΔGf°(Pb2+) =
ΔGr°となるので、
ΔGf°(Pb2+)
= -147.06 -
(-122.63)
=
-24.43 (kJ mol-1)
ここで、ギブズエネルギーが小さくなる方向に反応は進むので、
金属の酸化されやすさは以下のようになります。
Zn > Fe > Pb > (H2) >Cu
計算量が多く、途中、引っ掛かりそうな箇所がいくつかありますが、
考え方自体はそんなに難しいものではありません。
時間があれば、きちんと解けるのでしょうが…。
つづく。
